La Leptospirose est l’une des pathologies infectieuses majeures de la Nouvelle-Calédonie. Maladie endémique (des cas sont diagnostiqués tout au long de l’année), elle connait également des poussées épidémiques pendant les mois chauds et pluvieux. Les contaminations humaines sont classiquement rencontrées dans les zones d’élevage de la côte Ouest et en milieu rural, notamment mélanésien (habitat en tribu), en particulier dans le Nord-Est de la Grande Terre, mais elle représente également une menace en zone d’habitat précaire à la périphérie de Nouméa. Afin d’améliorer sa surveillance, la Leptospirose a été inscrite sur la liste des maladies à déclaration obligatoire. L’Institut Pasteur de Nouvelle-Calédonie (IPNC) traite la totalité des examens nécessaires au diagnostic biologique de la Leptospirose prescrits sur le territoire et transmet en direct l’ensemble des résultats à la Direction des Affaires Sanitaires et Sociales de la Nouvelle-Calédonie. Cette situation confère aux résultats du laboratoire un caractère exhaustif et donc un intérêt épidémiologique certain.
Table des matières :
Agent étiologique : les Leptospires pathogènes
Les Leptospira sont des bactéries appartenant à l’ordre des Spirochètes, qui comprend d’autres genres pathogènes majeurs : Borrelia et Treponema notamment.
Morphologiquement, ce sont de longs et fins bacilles hélicoïdaux avec une extrémité en crochet. La taille habituelle est de 0,1 µm de diamètre pour une longueur de 6 à 20µm. En microscopie optique, ils ne sont visibles qu’avec un microscope à fond noir.
La classification sérologique des Leptospires pathogènes distingue plus de 230 sérovars pathogènes, regroupés selon leur proximité en sérogroupes. Le genre Leptospira contient aussi des espèces inféodées et limitées aux milieux hydriques et telluriques, qualifiés de saprophytes.
La classification génétique, introduite plus récemment, définit 20 espèces différentes : 9 espèces pathogènes, 6 espèces saprophytes ainsi que 5 espèces dites intermédiaires, de virulence moindre ou mal documentée.
Malheureusement et compliquant l’étude de l’épidémiologie de la leptospirose, un sérogroupe regroupe le plus souvent des souches appartenant à plusieurs espèces, tout comme une espèce se trouve partagée entre de nombreux sérogroupes.
Une zoonose à l’épidémiologie complexe
La Leptospirose est à la fois une zoonose (maladie commune à l’homme et à une ou plusieurs espèces animales) et une maladie environnementale ; son épidémiologie est donc particulièrement complexe. La présence de leptospires pathogènes dans l’environnement (les eaux douces et les boues), est l’un des éléments essentiels de leur transmission à l’homme, mais aussi aux animaux. Les Mammifères infectés éliminent des leptospires infectieux par voie urinaire dans leur environnement, exposant ainsi tout animal sensible à un risque de contamination. Les animaux sont plus ou moins sensibles en fonction de l’espèce et de la souche de leptospire qui les infecte. Lorsqu’ils sont infectés par une souche qui est très adaptée à leur espèce, ils ne présentent pas de maladie mais deviennent porteurs et excréteurs chroniques de leptospires qui se multiplient dans leurs reins sans causer de lésions. Les rongeurs représentent le réservoir sauvage le plus important et assurent la pérennité des souches responsables du plus grand nombre des cas humains. En Nouvelle-Calédonie, 4 espèces de rongeurs, toutes introduites (le surmulot Rattus norvegicus, le rat noir Rattus rattus, le rat polynésien Rattus exulans et la souris Mus musculus), entretiennent des souches de leptospires responsables d’environ 75% de cas humains de leptospirose. La survie des leptospires dans l’eau douce et dans les sols humides à pH neutre ou légèrement alcalin est favorisée par la chaleur, l’humidité (à l’abri de la lumière solaire directe), ce qui explique l’incidence plus élevée de la leptospirose dans la zone intertropicale.
La peau lésée (une égratignure insignifiante peut suffire) ou macérée par un séjour prolongé dans l’eau douce (baignade) d’une part, et les muqueuses d’autre part, constituent les voies d’entrée privilégiées des leptospires. Deux modes de contamination sont souvent évoqués, directe et indirecte, la première (contact avec les urines, la vessie ou les reins d’animaux infectés) étant la moins fréquente et rendant compte de l’existence de maladies professionnelles (agents de voirie, agriculteurs, éleveurs, employés d’abattoirs, vétérinaires). La contamination indirecte, qui est liée à la présence de l’homme lors de ses activités professionnelles ou de loisirs dans un environnement infecté, reste prépondérante en Nouvelle-Calédonie. Dans les zones tropicales ou subtropicales comme la Nouvelle-Calédonie, la contamination est certes continue mais étroitement liée aux conditions climatiques favorables à la survie et à la dissémination des leptospires (température, humidité), à l’exposition des humains aux milieux contaminants (inondations) ou à la prolifération des rongeurs réservoirs.
L’incidence de la leptospirose est étroitement liée aux variations météorologiques. En zone tempérée, une recrudescence des cas est observée pendant l’été et l’automne ; dans la zone intertropicale, une transmission quasi-continue s’accompagne de variations saisonnières liées au régime des pluies ou à des évènements météorologiques exceptionnels (cyclones, dépressions). En France métropolitaine, le niveau d’endémie est faible avec une moyenne de 200 à 300 cas annuels. En Nouvelle-Calédonie, elle était par exemple en 1999 de 122 cas / 100.000 habitants avec un pic en février-mars en saison chaude et pluvieuse. Des foyers permanents de leptospirose ont été décrits en relation avec les activités d’élevage, notamment bovin, par exemple dans la région de Bourail. Mais une part importante des contaminations reste liée aux mauvaises conditions d’hygiène de l’environnement, en particulier en milieu tribal et à la périphérie de Nouméa où l’habitat précaire se développe. Enfin, les modifications des activités humaines doivent être prises en considération comme l’augmentation depuis quelques années des contaminations à l’occasion d’activités de loisirs « pleine nature » entraînant des contacts prolongés avec de l’eau douce (canoë-kayak, canyoning, raids…).

Une symptomatologie variée et non spécifique
Les signes et symptômes les plus fréquents dans les cas de leptospirose sont la fièvre, les céphalées, les myalgies et l’ictère dans un contexte d’hyperleucocytose, de thrombopénie et d’inflammation (augmentation significative de la CRP et de la vitesse de sédimentation). La guérison spontanée semble relativement fréquente mais un certain nombre de patients évoluent vers des formes plus sévères. La forme grave la plus anciennement reconnue et la plus caractéristique est connue sous le nom de syndrome de Weil qui combine des atteintes hépatique et rénale avec des hémorragies. En l’absence de traitement, l’insuffisance rénale peut s’accompagner d’un état de choc et d’une défaillance polyviscérale rapidement mortelle. Une autre forme grave de leptospirose, reconnue plus récemment, est constituée d’une hémorragie pulmonaire sévère à l’issue fréquemment fatale. D’autres formes cliniques existent, comme des méningites ou, plus tardivement après l’infection, des uvéites. Toutefois, les formes fébriles pures, pseudo-grippales sont de loin les plus fréquentes.
Ainsi, la présentation clinique variée mais non spécifique rend son diagnostic clinique difficile et aléatoire, surtout dans le contexte tropical où se pose le problème du diagnostic différentiel avec d’autres pathologies comme les arboviroses (dengue, chikungunya), les hépatites virales, le paludisme ou d’autres infections virales, la grippe ou les infections à Hanta virus notamment. Le diagnostic biologique demeure donc indispensable pour la confirmation des cas de leptospirose.
Diagnostic biologique de la leptospirose
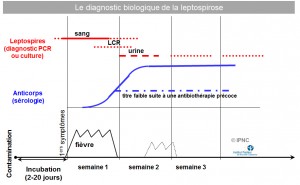
Comme dans de nombreuses maladies infectieuses, le diagnostic peut initialement être direct lorsqu’il met en évidence les leptospires (ou leur génome) puis indirect mettant en évidence les anticorps anti-leptospires produits en réponse à l’infection.
- Mise en évidence des leptospires : culture et diagnostic moléculaire
Historiquement, les leptospires étaient mis en évidence par isolement et culture. Toutefois, leur culture est longue (temps de croissance lent) et fastidieuse (exigences métaboliques particulières nécessitant l’utilisation d’un milieu de culture très complexe). Ainsi, l’isolement des leptospires à partir des prélèvements de sang ou d’urine nécessite un délai de 15 jours à 4 mois. Cet isolement présente un intérêt certain pour les études sur la leptospirose (notamment la surveillance épidémiologique) mais le délai du diagnostic limite fortement son intérêt pour le praticien qui souhaite un diagnostic précoce rapide, puisqu’une décision thérapeutique rapide peut s’imposer en cas de forme grave.
Le développement des techniques de biologie moléculaire en laboratoire de diagnostic a logiquement trouvé dans ce contexte une application de choix. Une technique de diagnostic par amplification génique (PCR) a été mise au point à l’Institut Pasteur à Paris puis développée et validée à l’Institut Pasteur de Nouvelle-Calédonie en zone d’endémie dès les années 1990. Une détection du génome des leptospires par PCR est en moyenne possible dès l’apparition des premiers symptômes et jusqu’à 8 jours après l’apparition des symptômes dans le sang des patients, puis parfois au-delà de 15 jours dans les urines. Cette technique a permis de fournir un résultat au clinicien dans un délai de 2 à 4 jours ouvrés, constituant un net progrès par rapport à la culture. Ce délai a été encore raccourci avec l’apparition et l’utilisation de la PCR en temps réel qui permet de donner un résultat quantitatif dans la demi-journée. L’IPNC a développé et utilise une telle technique depuis 2005.
- Mise en évidence des anticorps spécifiques : techniques sérologiques
Plusieurs techniques sont utilisables pour le diagnostic sérologique de la leptospirose.
Le Test de Micro-Agglutination (MAT) constitue la technique de référence ; il dérive de l’ancienne réaction d’agglutination-lyse (RAL) mise au point par Martin et Pettit en 1918. Ce test est utilisé pour la mise en évidence et le titrage des anticorps sériques mais aussi pour l’identification et le sérotypage des souches isolées. Son principe est basé sur la lecture au microscope à fond noir du pouvoir agglutinant du sérum à tester vis-à-vis de cultures vivantes de Leptospira. Un panel de souches (ou « antigènes » dans la terminologie du MAT) choisies en fonction de la fréquence connue de certains sérovars et de la probabilité de les rencontrer selon les critères épidémiologiques locaux, est constituée pour permettre l’identification du sérogroupe en cause lors d’une infection à Leptospira. Ainsi, pour les prélèvements de Nouvelle-Calédonie et de Wallis et Futuna, les 11 antigènes suivants sont utilisés :
| Sérogroupe |
Sérovar |
Souche |
| Australis |
Australis |
Ballico |
| Autumnalis |
Autumnalis |
Akiyami A |
| Ballum |
Castellonis |
Castellon 3 |
| Bataviae |
Bataviae |
Van Tienen |
| Canicola |
Canicola |
Hond Utrecht |
| Icterohaemorrhagiae |
Icterohaemorrhagiae |
Verdun |
| Copenhageni |
Winjberg |
| Panama |
Panama |
CZ 214 K |
| Pomona |
Pomona |
Pomona |
| Pyrogenes |
Pyrogenes |
Salinem |
| Semaranga |
Patoc |
Patoc I |
Au besoin, en particulier à l’occasion d’enquêtes régionales, un panel plus large (23 souches ou antigènes) est utilisé. Pour garantir la qualité de cette analyse, l’Institut Pasteur de Nouvelle-Calédonie participe depuis 2001 à des programmes internationaux de contrôle externe de qualité (National Reference Laboratory de Melbourne et Queensland Health Scientific Services, Brisbane).
L’interprétation des résultats sérologiques est parfois délicate et doit impérativement tenir compte des techniques utilisées, du sérogroupe en cause, de la chronologie des prélèvements dans le décours de la maladie et de la thérapeutique antibiotique éventuellement instituée. L’étude de la cinétique des anticorps agglutinants sur deux, voire trois, sérums espacés chacun d’environ une dizaine de jours est le plus souvent indispensable pour l’interprétation et la détermination du sérogroupe en cause.
Les anticorps agglutinants sont détectables après la première semaine de la maladie. L’obtention en MAT d’un titre au 1/100 vis-à-vis d’un ou plusieurs antigènes constitue une réaction positive au seuil mais ne permet en aucun cas de confirmer qu’il s’agit d’une leptospirose récente. L’examen d’un second sérum 8 à 10 jours plus tard est nécessaire pour mettre en évidence une ascension sérologique avec un titre supérieur ou égal d’au moins deux dilutions d’un facteur 2 en cas de leptospirose évolutive. De même, une séroconversion sur deux prélèvements séquentiels peut être observée à partir d’un premier sérum précoce négatif. Les réactions croisées, habituelles sur un sérum précoce, ont tendance à disparaître en phase de convalescence. A ce stade l’antigène donnant le titre le plus élevé correspond habituellement au sérogroupe en cause. Enfin, il faut signaler qu’une antibiothérapie précoce peut minimiser voire décapiter la réponse sérologique.
L’ELISA est une technique sérologique qui peut présenter de multiples variantes quant à la nature de l’antigène utilisé et aux réactifs mis en oeuvre dans la réalisation du test. L’antigène choisi est un extrait formolé et thermolysé habituellement de la souche saprophyte Patoc I, mais d’autres sérovars peuvent être utilisés. Un délai de réponse identique à celui du MAT (voire plus court d’un à 2 jours) est généralement observé. En revanche, il se négative plus rapidement, environ deux mois après le début de la maladie. Ce test ELISA trouve tout son intérêt dans le diagnostic différentiel entre leptospirose évolutive et leptospirose ancienne dans la mesure où les anticorps résiduels d’infections ou de vaccinations antérieures ne sont pas décelés par cette technique. C’est une technique sensible et spécifique qui doit être considérée comme un test sérologique de dépistage comparativement au MAT qui demeure la technique de référence et devrait être systématiquement mis en œuvre pour confirmer un résultat d’ELISA. Cependant, le test ELISA est faussement négatif dans un fort pourcentage des leptospiroses à certains sérogroupes (comme Grippotyphosa ou, dans une moindre mesure, Australis). L’utilisation comme antigènes de plusieurs souches de leptospires appartenant à des sérogroupes différents améliore sensiblement les résultats comparativement à l’utilisation d’un antigène consensus de la souche saprophyte Patoc I, mais rend le test plus long et plus coûteux.
Les tests rapides unitaires sur bandelette de nitrocellulose (dispstick-assay) sont adaptés à un support solide sur membrane. Ces tests donnent des résultats satisfaisants pour un dépistage, mais leurs spécificité et sensibilité sont moindres que celles de l’ELISA. L’intérêt de ces réactifs repose dans leur facilité de mise en œuvre et l’utilisation possible au coup par coup dans des centres médicaux périphériques ou lointains. Ils restent en revanche d’un coût élevé qui limite leur large diffusion.
Antibiothérapie
Les leptospires sont habituellement sensibles à la plupart des antibiotiques. Les traitements standards reposent sur l’utilisation de pénicillines (ampicilline, amoxycilline, pénicilline), de tétracyclines (oxytétracycline, doxycycline) ou de fluoroquinolones (ciprofloxacine).
Il a été montré que l’antibiothérapie était la plus efficace au cours de la phase précoce de la maladie et que la précocité de sa mise en œuvre était un élément déterminant du pronostic. Ainsi, il est généralement recommandé de traiter les patients sur la seule base d’une suspicion (clinique et épidémiologique) de leptospirose, sans attendre le résultat du diagnostic biologique. L’utilité de l’antibiothérapie lors de la phase immune de la maladie demeure controversée pour prévenir les complications mais reste souhaitable notamment pour éviter la possibilité de formes plus rares (notamment uvéites) liées à des infections chroniques.
La vaccination, une mesure de prévention ?
Tant en médecine humaine qu’en médecine vétérinaire, seuls les vaccins inactivés composés de corps bactériens entiers tués par le formol sont utilisés. Ils procurent une protection limitée au(x) sérogroupe(s) contenu(s) dans le vaccin. De plus la protection conférée reste de courte durée et des rappels sont nécessaires tous les deux ans. En France, la vaccination humaine instaurée en 1975 s’adressait d’abord aux égoutiers parisiens, population à risque exposée quotidiennement aux rats. Il s’agit d’un vaccin monovalent obtenu à partir du sérovar Icterohaemorrhagiae dont les rats sont réservoirs. Si ce vaccin a fait la preuve de son efficacité chez l’adulte dans ce contexte épidémiologique très particulier, ceci ne justifie pas son utilisation généralisée ; ses indications demeurent donc limitées et doivent être évaluées au cas par cas. Le développement d’un vaccin efficace en terme de protection tant pour l’homme que pour l’animal reste donc à l’ordre du jour et fait l’objet de nombreux travaux.

Au quotidien, les méthodes de protection individuelles et collectives

Les méthodes de protection individuelle comme le port de gants, bottes et lunettes sont applicables pour certaines catégories professionnelles à risques (égoutiers, personnels des abattoirs, vétérinaires,…). Cette recommandation apparait par contre peu réaliste pour le grand public chez qui le risque, bien qu’omniprésent en particulier dans l’environnement tropical, est méconnu. L’exemple de la Nouvelle-Calédonie est remarquable et rend bien compte de la difficulté de faire passer certains messages de prévention, essentiellement ciblés sur le contrôle et l’élimination des rongeurs. Les recommandations de base sont alors de ne pas constituer de décharges sauvages, de ranger la nourriture à l’intérieur des habitations dans des zones fermées et de ne pas laisser trop de fruits au sol dans l’entourage des habitations. Une autre recommandation est de ne pas marcher pieds nus dans les zones humides ou encore d’éviter de se baigner en eau douce dans les zones à risque (en périphérie ou en aval des zones d’élevage ou d’abattage) surtout en présence de plaies cutanées. Le nettoyage des plaies à l’eau potable et au savon et le port de pansements étanches sur celles-ci sont également recommandés.

En conclusion….
La leptospirose est une maladie infectieuse majeure, souvent sous-estimée car méconnue des professionnels de santé et de diagnostic, tant clinique que biologique, difficile. Connue en zone tempérée comme maladie essentiellement professionnelle, elle est en zone intertropicale une pathologie émergente ou ré-émergente dont l’épidémiologie est multiple. Si les tests de laboratoire tendent actuellement à se diversifier, ils restent néanmoins le plus souvent limités à quelques laboratoires spécialisés. Enfin, sa prise en charge thérapeutique est facile par les antibiotiques, à condition que le traitement soit instauré précocement de façon présomptive. Le retard à l’antibiothérapie est une cause majeure d’évolution vers des formes graves.
Autres ressources disponibles sur ce thème :
Programme de Recherche sur la Leptospirose en Nouvelle-Calédonie
Dossier Scientifique sur la leptospirose
Poster Leptospirose – Diagnostic et travaux de recherche de l’Institut Pasteur
La surveillance de la leptospirose en Nouvelle-Calédonie : approche pluridisciplinaire d’une zoonose endémique. Bulletin épidémiologique, santé animale et alimentation.
Publications de l’Unité de Recherche et d’Expertise sur la Leptospirose
Liens externes recommandés :
Site du centre collaborateur de l’OMS à Brisbane (Australie)
Centre National de Référence France – Institut Pasteur
Réseau Océanien de Surveillance de la Santé Publique
Sur le site de la Direction des Affaires Sanitaires et Sociales de la Nouvelle-Calédonie :
Page Leptospirose (incluant la situation récente)
Fiche de déclaration obligatoire à joindre aux prélèvements
Thème de Santé Leptospirose
Le portail des Maladies à Déclaration Obligatoire