Porteurs du projet : Dr A.Loarec, Dr M. Buchy (CHT), Dr B. Creugnet, Dr N. Deboucher (CSSR), Dr. D. Megraoua (ASS-NC)
Collaborateurs : D. Ukeiwe, Dr. J. Colot, Dr. Jouan
Partenaires : CHT, UNC, IPP, RIKEN IMS (Japon),
Dates : A partir de Septembre 2025 ( Fin prévue en 2026)
Le projet MINDO (Microbiota In New Caledonia Diabetes Obesity) a pour objectif d’explorer les liens entre le microbiote intestinal (l’ensemble des micro-organismes vivant dans l’intestin), le métabolome fécal (les petites molécules produites ou modifiées par ces micro-organismes), et deux grandes problématiques de santé publique en Nouvelle-Calédonie : l’obésité et le diabète de type 2.
Portée par l’Institut Pasteur de Nouvelle-Calédonie en partenariat avec plusieurs établissements de santé calédoniens, l’Université de Nouvelle-Calédonie, ainsi que des laboratoires de recherche internationaux, l’étude prévoit d’inclure 270 adultes, répartis entre patients diabétiques, patients obèses non diabétiques, et sujets témoins. Chaque groupe comprendra des participants habitant depuis au moins 3 ans sur le territoire et issus de trois communautés de Nouvelle-Calédonie : mélanésienne, polynésienne et européenne.
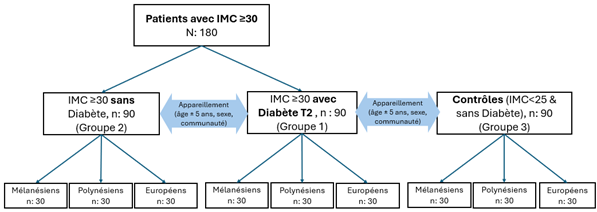
Des prélèvements de sang, d’urines et de selles seront réalisés, accompagnés d’un recueil de données médicales et de questionnaires portant sur l’alimentation, l’activité physique, et le bien-être. Ces informations permettront d’approfondir la compréhension des interactions entre l’environnement intestinal, les habitudes de vie et les déséquilibres métaboliques.
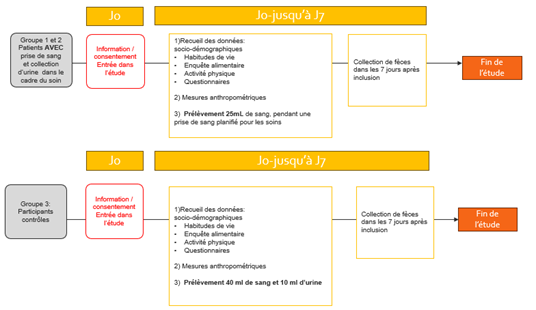
Le recrutement commencera en septembre 2025, après obtention des autorisations éthiques.
Ce projet constitue une étape majeure dans le développement de la recherche médicale en Nouvelle-Calédonie, avec pour ambition de mieux adapter les stratégies de prévention et de soins aux réalités locales.