ARCANE : Approche intégrée environnementale de l’antibiorésistance via l’analyse des eaux
Contexte :
L’émergence et la propagation rapides de bactéries pathogènes (multi)résistantes aux antimicrobiens est un enjeu de santé prioritaire au niveau mondial. Malgré son insularité, la Nouvelle-Calédonie n’a pas été préservée de cette pandémie : le territoire a ainsi été le pays hôte du premier isolat français porteur du gène plasmidique mcr-1 (conférant une résistance à la colistine). D’autres résistances sont de plus en plus préoccupantes car elles entraînent des problèmes de santé publique importants sur le territoire. A titre d’exemple, le Staphylococcus aureus résistant à la méthicilline diffuse au sein de la population avec des souches à haute virulence et les Entérobactéries Productrices de Carbapénémases (EPC) sont impliquées dans des épidémies au sein du Centre Hospitalier Territorial.
La sélection et la transmission de ces résistances sont fréquemment investiguées via des études cliniques et ce n’est que récemment que le rôle de l’environnement comme source et voie de diffusion de la résistance aux antibiotiques a été reconnu. En effet, les effluents des hôpitaux, de l’industrie, des structures d’élevage ou vétérinaires, des stations d’épuration et des eaux de ruissellement urbaines/agricoles sont autant de sources potentielles de nouveaux contaminants (antibiotiques, biocides, métaux, gènes de résistance, bactéries résistantes) pouvant se déverser dans les milieux récepteurs. Au-delà des apports anthropiques, les fortes concentrations en métaux retrouvées naturellement peuvent constituer des facteurs favorables à l’émergence et/ou la sélection de bactéries résistantes aux antibiotiques. En effet, les gènes de résistance aux métaux et aux antibiotiques peuvent être situés sur les mêmes éléments génétiques mobiles (co-resistance), ou un mécanisme identique peut être impliqué dans la résistance aux antibiotiques et aux métaux (cross-resistance).

Eaux usées , Lagunage de Paiamboué, Koné © Kainiu Malia
Parmi les techniques visant à mettre en évidence ces sources de contaminants et les risques pour la santé humaine, l’épidémiologie basée sur l’analyse des eaux usées via des approches métagénomiques s’est développée ces dernières années. Ces approches innovantes permettent d’identifier les espèces bactériennes mais aussi de quantifier et décrire des milliers de gènes (ex. de résistance ou de virulence) dans un échantillon donné.
En Nouvelle-Calédonie, à ce jour, aucune étude visant à identifier des bactéries résistantes dans les eaux usées, les eaux de ruissellement ou le milieu récepteur n’a été menée. Il existe pourtant un besoin réel sur le territoire puisque, lors de fortes pluies par exemple, il n’est pas rare d’assister à des phénomènes de contaminations bactériennes des zones de baignade. Le suivi sanitaire des eaux de baignade est réalisé annuellement pendant la période estivale (de décembre à avril) par la Direction des Affaires Sanitaires et Sociales du gouvernement de la Nouvelle-Calédonie sur l’ensemble du territoire. Dans certaines communes, des analyses complémentaires et réglementaires sont également réalisées. Ces suivis portent sur le dénombrement des Escherichia coli et des entérocoques intestinaux sans information sur le niveau de résistance aux antibiotiques de ces souches, pourtant reconnues comme étant potentiellement porteuses de résistances.
Financement :
Ce projet est financé par le Consortium pour la recherche, l’enseignement supérieur et l’innovation
en Nouvelle-Calédonie, le gouvernement de la Nouvelle-Calédonie et l’IPNC.
Objectifs :
Dans ce contexte, les objectifs du projet ARCANE sont d’évaluer la dissémination des gènes de résistance et des bactéries résistantes aux antibiotiques dans l’environnement, via une approche intégrée environnementale innovante. Grâce au développement d’une technologie novatrice de suivi des concentrations en métaux et en antibiotiques, ce projet permettra également d’identifier de possibles facteurs d’origine anthropique ou environnementale susceptibles de favoriser la sélection, le développement et la dissémination de souches résistantes.
Ce projet regroupe trois partenaires du CRESICA : l’Institut Pasteur de Nouvelle-Calédonie (IPNC), le Centre Hospitalier Territorial (CHT) via les laboratoires de bactériologie,d’Hygiène et Environnement et de Toxicologie, et l’Institut de Recherche pour le Développement (IRD) via le Laboratoire des Moyens Analytiques (LAMA). La partie métagénomique sera réalisée en partenariat avec l’Institut Pasteur à Paris (IPP) et les dosages des métaux et des antibiotiques impliqueront le laboratoire AEL. Ce projet associe également les collectivités et insitutions de la Nouvelle-Calédonie compétentes au niveau sanitaires (DASS, DAVAR, Mairie de Nouméa, Mairie de Dumbéa, SIVOM-VKP), ainsi qu’au niveau de l’Environnement (Province Sud et Province Nord) pour les différents sites échantillonnés, les établissements de soins concernés par l’étude (CHT, PSN) ainsi que les gestionnaires des systèmes d’épurations retenus (CDE et Epureau).
Du point de vue « Une seule Santé », cette approche intégrée de l’antibiorésistance permettra d’identifier des points critiques susceptibles d’être la cible d’actions de contrôle visant à limiter la propagation de la résistance aux antibiotiques. Sur le long terme, cette approche via l’analyse des eaux usées, pourrait être utilisée dans le suivi au long cours de l’évolution de l’antibiorésistance et comme mesure de l’impact des mesures correctives mises en place.
Méthode :
Échantillonnage
Le suivi sera réalisé de façon longitudinale lors d’une campagne de prélèvements sur 14 mois (Prélèvements tous les deux mois). Les sites d’échantillonnages ciblés suivent le parcours des eaux usées : des effluents des structures de soins jusqu’au milieu récepteur en passant par les structures mises en place pour l’assainissement. Des prélèvements ponctuels d’eau ainsi que des bilans 24h seront réalisés sur certains sites pour avoir un échantillon représentatif.

Echantillonnage d’Eaux usées, Lagunage de Paiamboué, Koné © Bourles Alexandre
Culture
Concernant les isolements, une sélection d’isolats environnementaux, avec un focus plus particulier sur les Entérobactéries Productrices (i) de carbapénémases, (ii) de béta-lactamases à spectre étendu et (iii) de céphalosporinases de hauts niveaux est réalisé. La technique repose sur l’ensemencement directement sur un milieu de culture ou la filtration d’échantillons d’eau et le dépôt des membranes sur des géloses sélectives permettant d’isoler des entérobactéries résistantes aux β-lactamines. Une identification par MALDI-ToF est réalisée et des tests de synergie permettent d’identifier le mécanisme de résistance impliqué. Les isolements permettent d’obtenir une vue d’ensemble du panel de résistance retrouvé au sein des bactéries cultivables dans l’environnement en Nouvelle-Calédonie. En fonction des résultats, un certain nombre d’isolats sera soumis à un séquençage du génome complet qui permettra d’identifier les gènes et les éléments génétiques mobiles impliqués dans la résistance et qui servira de référence pour les analyses en métagénomique. En parallèle, des génomes complets d’isolats cliniques et de l’environnement hospitalier d’intérêt alimenteront la base de données.
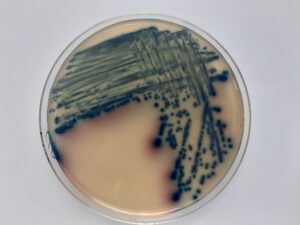
Colonies d’Escherichia coli sur gélose chromogène, © Bourles Alexandre
Métagénomique
Pour la métagénomique, la technique proposée consiste à recueillir les organismes et débris d’organismes présents dans l’eau par filtration à 0,22 µm. L’ADN sera extrait puis un séquençage de type Shot Gun sera réalisé. Cette approche permet d’avoir un aperçu global de la composition du microbiome ainsi que son potentiel fonctionnel par l’identification des gènes et des éléments génétiques mobiles représentés. Les séquences consensus obtenues après assemblage des lectures issues du séquençage seront alignées sur des génomes référencés pour l’identification des espèces formant le microbiome. Des comparaisons des communautés bactériennes échantillonnées dans les différents environnements ainsi que des profils de résistance et leurs variations dans le temps et l’espace seront réalisées. L’approche longitudinale de la source aux eaux littorales permettra de décrire finement les transferts de germes et de gènes de résistance et de documenter les risques sanitaires.
Suivi intégrateur des métaux et des antibiotiques
Une technique intégratrice pour l’analyse des éléments traces métalliques et des antibiotiques à l’état de traces et ultra-trace sur résine en couche mince (Diffusive Gradient in Thin film ; DGT) sera utilisée en supplément de dosages classiques sur des eaux.
ARCANE: Integrated environmental approach to antibiotic resistance via water analysis
The rapid emergence and spread of pathogenic bacteria (multi)resistant to antimicrobials is a priority health issue. Despite its insularity, New Caledonia has not been spared from this pandemic: the territory was the host country of the first French isolate carrying the plasmid gene mcr-1 (conferring resistance to colistin). Other resistances are of increasing concern because they cause significant public health problems in the territory. For example, methicillin-resistant Staphylococcus aureus is spreading in the community with highly virulent strains and Carbapenem Resistant Enterobacteriaceae (CRE) are involved in epidemics in the Territorial Hospital.
The selection and transmission of these resistances are frequently investigated through clinical studies and it is only recently that the role of the environment as a source and pathway for the diffusion of antibiotic resistance has been recognized. Indeed, effluents from hospitals, industry, livestock or veterinary structures, wastewater treatment plants and urban/agricultural runoff are all potential sources of new contaminants (antibiotics, biocides, metals, resistance genes, resistant bacteria) that can be discharged into receiving environments. In addition to anthropogenic inputs, the high concentrations of metals found naturally can also add factors favoring the emergence and/or selection of antibiotic-resistant bacteria. Indeed, the genes for resistance to metals and antibiotics may be located on the same mobile genetic elements (co-resistance), or an identical mechanism may be involved in resistance to antibiotics and metals (cross-resistance).
Among the techniques aimed at highlighting these sources of contaminants and the risks to human health, epidemiology based on wastewater analysis via metagenomic approaches has been developed in recent years. These innovative approaches make it possible to identify bacterial species but also to quantify and describe thousands of genes (e.g. resistance or virulence) in a given sample.
In New Caledonia, no study aimed at identifying resistant bacteria in wastewater, runoff or the receiving environment has been conducted to date. However, there is a real need in the territory since, during heavy rains for example, it is not uncommon to see bacterial contamination of bathing areas. Sanitary monitoring of bathing waters is carried out annually during the summer period (from December to April) by the New Caledonian Government’s Department of Health and Social Affairs throughout the territory. In some municipalities , additional analyses are also carried out. This monitoring focuses on the enumeration of Escherichia coli and intestinal enterococci without assessing antibiotic resistance.
Fundings:
CRESICA, New Caledonia Government, IPNC
Objectives:
In this context, the objectives of the ARCANE project are to evaluate the dissemination of resistance genes and antibiotic-resistant bacteria in the environment, with an innovative integrated environmental approach. Thanks to the development of an innovative technology for monitoring metal and antibiotic concentrations, this project will also identify possible factors of anthropic or environmental origin likely to promote the selection, development and dissemination of resistant bacterial strains.
This project includes three CRESICA partners: Institut Pasteur of New Caledonia, New Caledonia Central Hospital CHT, and French National Research Institute for Sustainable Development IRD.The metagenomic part will be carried out in partnership with the Institut Pasteur in Paris and the assays of metals and antibiotics will involve the private company AEL. This project also involves the New Caledonian authorities and institutions responsible for health (DASS, DAVAR, Noumea municipality, Dumbéa municipality, SIVOM-VKP), as well as the Environment (South Province and North Province) for the different sampling sites, the health care institutions concerned by the study and the managers of the wastewater treatment systems selected.
Methods:
Sampling
The monitoring will be carried out longitudinally during a 14-month sampling campaign (sampling every other month). The targeted sampling sites follow the path of wastewater: from the effluents of the healthcare structures to the receiving environment. Punctual water sampling as well as 24-hour sampling will be carried out on certain sites.
Culture
Concerning the isolations, a selection of environmental isolates, with a particular focus on Enterobacteriaceae producing (i) carbapenemases, (ii) extended spectrum beta-lactamases and (iii) high level of cephalosporinsase is carried out. The technique is based on direct plating on culture medium or filtration of water samples and deposition of membranes on selective agars to isolate β-lactam resistant Enterobacteriaceae. An identification by MALDI-ToF is performed and synergy tests allow to identify the resistance mechanism involved. These isolations will provide an overview of the resistance mechanisms found in cultivable bacteria in the environment. Some isolates will be subjected to whole genome sequencing to identify the repertoire of genes and mobile genetic elements involved in resistance to serve as a reference repertoire for metagenomics analyses. In parallel, complete genomes of clinical and hospital isolates of interest will be added to the database.
Metagenomic
For metagenomics, the proposed approach consists in collecting organisms and debris (from organisms) present in water by filtration at 0.22 µm. The DNA will be extracted and subjected to shotgun sequencing. This approach allows to gain a global view of the microbiome as well as its functional potential by identifying the genes and mobile genetic elements represented. The consensus sequences obtained after assembly of the sequencing reads will be aligned with referenced genomes for the identification of the species forming the microbiome. Comparisons of bacterial communities sampled in different environments as well as resistance profiles and their variations in time and space will be performed. The longitudinal approach from the source to the coastal waters will allow a detailed description of the circulation of resistant bacteria and resistance genes and to inform the possible sanitary risks.
Integrative monitoring of metals and antibiotics
An integrative technique for the analysis of trace metals and trace and ultra-trace antibiotics on thin film resin (Diffusive Gradient in Thin film; DGT) will be used in addition to classical assays on waters.

